En atención a la creciente preocupación sobre la confianza en...
Leer más
Resultados finales de ensayo clínico señalan que la vacuna Ad5-nCoV (Convidecia) contra la COVID-19 es eficaz y segura
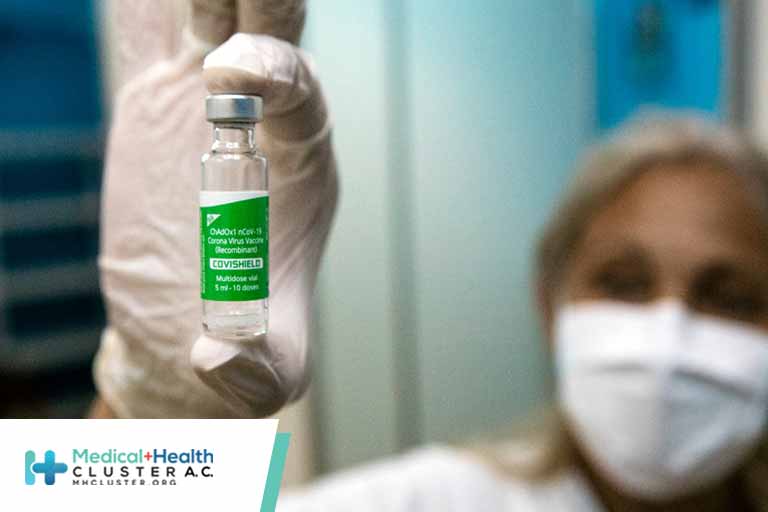
La vacuna Ad5-nCoV (Convidecia) contra la COVID-19, desarrollada en China por la farmacéutica CanSino Biologics, Inc. (CanSinoBIO), solo ha sido aprobada para uso de emergencia en 10 países. Esto por la falta de resultados de un ensayo clínico internacional fase III. Pero el día de hoy, los resultados de dicho ensayo clínico se publicaron en The Lancet, los autores concluyeron que la vacuna Ad5-nCoV tiene una efectividad del 57,5% contra infecciones sintomáticas y del 91,7% contra infecciones graves del virus.[1]
“Nuestro estudio sugiere que una dosis de Ad5-nCoV es altamente efectiva contra la enfermedad grave, esto podría ayudar a evitar hospitalizaciones y aliviar la tremenda carga que la COVID-19 ha impuesto sobre los sistemas de salud en el mundo. Además, como la vacuna es efectiva después de una sola dosis podría mejorar el acceso a la vacunación en países de bajos y medianos ingresos, donde puede ser más retador llevar a cabo una logística de doble dosis”, explicó el líder del estudio, el Dr. Scott Halperin, investigador de la Dalhousie University, en Halifax, Canadá.
La fase de reclutamiento del estudio clínico, registrado en clinicaltrials.gov (NCT04526990), inició el 22 de septiembre del 2020 y culminó el 15 de enero del 2021, con la participación de 36.727 sujetos provenientes de Paquistán, México, Rusia, Chile y Argentina.
Los criterios de inclusión fueron edad mínima de 18 años, aceptar el consentimiento informado, no padecer de condiciones médicas graves, no haber padecido COVID-19 con anterioridad, no encontrarse embarazada o amamantando y no haber recibido ninguna vacuna contra la COVID-19.
Los participantes fueron asignados de forma aleatoria a dos grupos, con una proporción de 1:1. Antes de la intervención se les extrajeron 25 ml de sangre. Después de esto recibieron una dosis intramuscular de la vacuna Ad5-nCoV o una dosis de placebo. Ni los sujetos de investigación ni el equipo que aplicó los inyectables sabían si recibían o aplicaban el placebo o la vacuna.
Todos los participantes fueron evaluados durante los 30 minutos siguientes a la intervención, para el análisis de efectos secundarios. En cuanto al seguimiento posterior, todos los sujetos de investigación fueron contactados semanalmente para que reportaran si tenían algún síntoma de infección por COVID-19. Ante la presencia de cualquier síntoma se realizaron pruebas de laboratorio para detectar SARS-CoV-2.
Los resultados mostraron que de los 10.590 participantes en el grupo placebo se presentaron 105 casos positivos de COVID-19, mientras que en el grupo de la vacuna solo se presentaron 45 casos en 10.660 participantes. Lo cual se traduce en una eficacia del 57,5% al día 28 después de la vacunación.
En cuanto a la eficacia contra una infección grave de COVID-19, se consideró que la enfermedad presentada era grave cuando los signos clínicos en reposo indicaban una condición sistémica grave, falla respiratoria, shock, falla renal, hepática o neurológica o la admisión a unidades de cuidados intensivos. La eficacia de la vacuna contra la enfermedad grave fue del 91,7%, a partir del día 28 después de la vacunación. No hubo decesos relacionados al SARS-CoV-2 en el grupo que recibió la vacuna.
La vacuna Ad5-nCoV fue bien tolerada y produjo niveles altos de anticuerpos contra el virus. La mayoría de los efectos adversos fueron leves o moderados, como dolor en el sitio de inyección, dolor muscular y dolor de cabeza. No se presentaron reportes de trombosis o trombocitopenia en ningún participante del estudio.
Nuevas variantes virales y las limitaciones de Ad5-nCoV
El ensayo clínico fase III muestra la eficacia de la vacuna producida por CanSino Biologics, Inc., pero también es importante tomar en cuenta sus limitaciones, considera el Dr. Richard Kennedy de la Mayo Clinic, en Estados Unidos.[2]
El experto, externo a la investigación, recordó que las muestras en este estudio fueron recolectadas antes del 15 de febrero del 2021 y por lo tanto no es posible saber su efectividad contra las variantes del virus que surgieron después, como es el caso de ómicron. Estas limitaciones también fueron reconocidas por el equipo de investigación.
“Aún se requiere más investigación para determinar la efectividad de Ad5-nCoV en largos periodos de tiempo, así como su efectividad contra las variantes de riesgo del virus, como lo es ómicron, que rápidamente está reemplazando a delta como la variante dominante a nivel mundial”, explicó la Dra. Joanne Langley, de la Universidad de Dalhousie, Canadá, colaboradora en el estudio.
De igual forma, los investigadores reconocen que hace falta analizar la eficacia de la vacuna contra las infecciones asintomáticas y explorar la eficacia relativa de una sola dosis contra un régimen de dosis doble.
El uso de emergencia de Ad5-nCoV en México
A pesar de que se han desarrollado 136 vacunas contra la COVID-19, solo 12 han sido aprobadas por la Organización Mundial de la Salud (OMS) para su uso de emergencia. La vacuna Ad5-nCoV desarrollada por CanSino Biologics, Inc., todavía no se encuentra en esa lista pero comenzó a utilizarse en México antes de tener los resultados del ensayo clínico fase III.
En México, la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS) aprobó el uso de emergencia de la vacuna Ad5-nCoV desde el 22 de marzo del 2021. Más de ocho meses antes de que se presentaran los resultados del ensayo clínico fase III. Pero la implementación temprana de la vacunación con Ad5-nCoV en México fue una decisión analizada.
“En el caso de las emergencias de salud pública, como es el caso de la pandemia por COVID-19, se aceptó, a través de estándares internacionales, lo que se llama la autorización para uso de emergencia. Esto quiere decir que todavía no se habían terminado los ensayos clínicos fase III, pero que ya se tenían lo que llamamos análisis intermedios de eficacia y seguridad, con tamaños de muestra suficientes para dar evidencia contundente de que sí hay una eficacia para la protección contra la infección y que existen datos que indican que el beneficio de la vacuna es mayor al riesgo de su aplicación, es decir que son seguras”, explicó la Dra. Celia Alpuche Arandas, directora del Centro de Investigación sobre Enfermedades Infecciosas del Instituto Nacional de Salud Pública, en México.
Ahora, los resultados del ensayo clínico fase III hablan sobre la eficacia y seguridad de la vacuna, que además incluyó un 35,8% de participantes de México. Lo cual implica una representatividad de la población de este país en el estudio. Aun así, los expertos concuerdan en que la investigación debe continuar.
“Es importante mencionar que pueden existir eventos adversos que, son muy raros, que no se van a ver ni siquiera en los ensayos clínicos fase III, sino hasta que se hayan aplicado millones de dosis. Esto no es una contraindicación para vacunar. Es algo muy duro y desafortunado para la persona a la que le ocurre, pero cuando se toman decisiones de salud pública ante una crisis, como la de la COVID-19, se ha llegado a la conclusión internacional de que estos son eventos tan raros, que el beneficio social de impedir la hospitalización de las personas o su fallecimiento por COVID-19 es muchísimo mayor que el riesgo de presentar un evento adverso raro”, señaló la Dra. Celia Alpuche Arandas.
De igual forma, el Dr. Richard Kennedy concluyó que hay una urgencia clara de continuar desarrollando, probando y utilizando nuevas vacunas: “Este estudio proporciona datos importantes que apoyan el uso de otra vacuna que emplea un vector de adenovirus. Ahora, será necesario continuar con el monitoreo de esta población de estudio, para responder a preguntas relacionadas con la duración de la protección, la necesidad de una dosis de refuerzo y la protección que confiere contra nuevas variantes, incluida ómicron”.
El ensayo clínico fase III fue financiado por CanSino Biologics Inc. y el Instituto de Biotecnología de Beijing, quienes participaron en el diseño pero no en el análisis de los resultados del estudio. El Dr. Scott Halperin recibió financiamiento de su institución para el desarrollo del ensayo clínico pero no recibió ningún otro financiamiento personal. El Dr. Richard B. Kennedy reporta tener una patente de polipéptidos SARS-CoV-2 y recibir regalías por propiedad intelectual de Initiatives to Change the World (ICW) Healthcare Ventures por esta patente y otras relacionadas con el desarrollo de vacunas basadas en péptidos. La Dra. Joanne Langley recibió financiamiento de su institución para el desarrollo del ensayo clínico pero no recibió ningún otro financiamiento personal. La Dra. Celia Alpuche Arandas no reporta tener conflictos de interés.
https://espanol.medscape.com/verarticulo/5908295#vp_1
Créditos: Comité científico Covid